Nutrición
Retardo de crecimiento intrauterino:
factor de riesgo para enfermedad cardiovascular en la adultez
1º parte
En los años recientes, ha emergido uno de los
tópicos más novedosos para la prevención de las enfermedades crónicas de la adultez, alrededor del concepto de que factores en la infancia temprana y en el útero pueden tener profundas
influencias en la salud a lo largo de la vida.
La inesperada relación descripta por David Barker en 1989 entre el bajo peso de nacimiento y las alteraciones metabólicas asociadas al mayor riesgo cardiovascular en la edad adulta, han generado
un especial interés en la vida prenatal como período critico para el desarrollo de las enfermedades crónicas de la adultez, demostrando una apreciable correlación entre el bajo peso de nacimiento
y un incremento en el riesgo para diabetes tipo 2, enfermedades cardíacas, hipertensión arterial, obesidad y cáncer.
Esta hipótesis surge relacionada al concepto de períodos críticos: el proceso de crecimiento y desarrollo humano es caracterizado por dramáticos cambios en el tamaño físico y la maduración,
existiendo períodos críticos definidos como estados del desarrollo en los cuales alteraciones fisiológicas incrementan el riesgo para condiciones adversas para la salud futura.
La hipótesis del origen fetal de las enfermedades crónicas propone que alteraciones en el estado nutricional y hormonal fetal resultan en adaptaciones del desarrollo que
cambian en forma permanente la estructura fisiológica y el metabolismo, predisponiendo a los individuos a las enfermedades crónicas de la adultez. El proceso que estimula o ejerce un insulto en
un período crítico o sensitivo del desarrollo con efectos a largo plazo ha sido denominado universalmente con el término inglés programming.
A pesar de que no hay todavía evidencias firmes acerca del mecanismo etiopatogénico y de la importancia causal de estas asociaciones, la interpretación que se ha dado es que los niños con bajo
peso para edad gestacional han sufrido retardo de crecimiento intrauterino (RCIU), el cual, además de afectar el tamaño total y la composición corporal, afecta
selectivamente el tamaño y función de varios órganos y tejidos para proteger el crecimiento y la sobrevida de otros. Los individuos con RCIU, entonces, se adaptan o son programados al ambiente
intrauterino adverso o empobrecido. De acuerdo con Barker, en términos de la evolución, es posible que el proceso refleje el beneficio de la plasticidad durante el desarrollo inicial. Consistente
con esto, la hipótesis postula que las enfermedades cardiovasculares pueden ser una consecuencia de adaptaciones a condiciones de deficiencias nutricionales fetales que son
beneficiosas en el corto plazo para la sobrevida, aunque tengan efectos adversos para la salud en la vida adulta.
• Bajo peso de nacimiento
El bajo peso
de nacimiento (BPN) se define como el peso al nacer igual o menor a 2500 g, independientemente de
la edad gestacional(1). Dado que el peso al nacer es un dato que habitualmente se recolecta en las instituciones, este indicador es utilizado
ampliamente tanto en estudios epidemiológicos como con criterios sanitarios, ya que los niños que integran esta categoría tienen serias consecuencias en lo referente a su sobrevida y calidad de
vida(2).
Estos niños deben diferenciarse entre los que nacen antes del término de su gestación, con peso adecuado a su
edad gestacional, constituyendo el subgrupo de los “niños pretérmino” (RNPT) y los nacidos a término, con peso igual o inferior a 2500g, menor al que correspondería para su edad gestacional, que
constituyen el subgrupo de los niños de “bajo peso para edad gestacional”
(BPEG) en este subgrupo podrían incluirse los niños que siendo pretérmino, no poseen un peso
adecuado para su edad gestacional real.
Los casos con peso menor al percentilo 10 para edad gestacional se consideran “pequeños para edad gestacional” (PEG), la utilización de este percentilo como punto de corte, permite identificar neonatos de riesgo de morbimortalidad a corto
plazo y establecer conductas terapéuticas adecuadas. Aquellos cuyo déficit ponderal se ubica por debajo del percentilo 3 son los que se denominan “retardo de crecimiento intrauterino” (RCIU)(3), estos niños presentan
además del riesgo inmediato de morbimortalidad, consecuencias a largo plazo, por lo que merecen un seguimiento prolongado.
• Etiología del RCIU
El RCIU constituye un grupo
heterogéneo, con múltiples etiologías superpuestas entre si. Las diferentes causas pueden ser agrupadas en aquellas que originan un potencial genético de crecimiento fetal limitado y las que
producen una disminución del aporte de nutrientes a través de una alteración placentaria o enfermedad materna.
Entre los factores maternos relacionados con el origen del RCIU se destacan los procesos cardiovasculares, la
hipertensión arterial, la diabetes, la pre-eclampsia y eclampsia, la malnutrición, la drogadicción y el tabaquismo(4-5).
Dentro de los factores placentarios, las anomalías vasculares, la placenta pequeña, las anomalías de la
implantación y las hemorragias se constituyen en las patologías más frecuentes.
Los factores fetales que pueden originar el RCIU son un potencial
genético bajo de crecimiento fetal, malformaciones como cardiopatías y otras dismorfias, alteraciones cromosómicas y las infecciones intrauterinas del grupo TORCH.
Por último, e interaccionando con todos los anteriores, los factores sociales ejercen su acción a largo
plazo. Las bajas condiciones socioeconómicas y la falla en la prevención del embarazo adolescente6,
limitan el peso y la talla materna afectando de ese modo el tamaño de la generación siguiente, el trabajo pesado y la nutrición inadecuada de la mujer embarazada condicionan un balance energético
negativo, lo que produce alteraciones endocrinológicas permanentes en el feto por exposición a stress desde la gestación.
• Epidemiología
En los países desarrollados, el 6.2% de los recién nacidos tiene bajo peso, de estos, el 68% son niños
pretérmino y sólo un 32% son RCIU.
En los países en desarrollo, el 16.4% de los niños recién nacidos son bajo peso, el número de los nacidos
pretérmino corresponde sólo a un 33% de estos niños por lo que la principal diferencia está dada por un 77% de niños de bajo peso y de término que han sufrido retardo de crecimiento
intrauterino (6). Estos últimos, a diferencia de los niños con bajo peso de países desarrollados, son en su mayoría simétricos, con bajo
peso pero también baja talla y menor circunferencia cefálica, lo que les ocasionará menor calidad de vida futura.
Según un informe del año 2000 de CLAP-OPS-OMS, “..los niños con RCIU tiene cinco veces más probabilidades de
morir durante el período neonatal, cuatro veces más probabilidad durante el período post-neonatal y 4.7 veces más de morir durante el primer año de vida, cuando se los compara con los niños
nacidos con peso adecuado.
1. World Health Organiztion. Division of Family Health. The incidence of low birth Weights: a critical review
of available information. World Health Stat Q. 1980; 33:197-224
2. de Onis N, Blösner N, Villar J. Levels and patterns of intrauterine growth retardation in developing
countries. Eur J Clin Nut 1998; 52: 55-15
3. Warshaw JB. Intrautrine growth restriction revisited. Growth, Genetics & Hormones 1992;
8:5-8
4. Howell EM, Pettit KL, Kingsley GT. Trends in maternal and infant health in poor urban neighborhoods: good
news from 1990s, but challenges remain. Public Health Rep 2005; 120: 409-17
5. Ashdown-Lambert JR. A review of low birth weight:predictors, precursosrs and mobidity outcomes. J R Soc
Health 2005; 125: 76-83
6. Goldenberg P, Figueiredo MdoC, Silva R de S. Adolescent pregnancy, prenatal care and perinatal outcomes in
Monte Claros, Minas Gerais, Brazil. Cad Saude Publica 2005; 21:1077-86
Autor: Dra. Gabriela Krochik - M.N. 80.212
Médica Asistente Servicio de Nutrición
Hospital JP Garrahan
Dra. Cármen S. Mazza - M.N. 31384
Jefa de Servicio de Nutrición
Hospital JP Garrahan
Retardo de crecimiento intrauterino:
factor de riesgo para enfermedad cardiovascular en la adultez
2º parte
En los años recientes, ha emergido uno de los
tópicos más novedosos para la prevención de las enfermedades crónicas de la adultez, alrededor del concepto de que factores en la infancia temprana y en el útero pueden tener profundas
influencias en la salud a lo largo de la vida.
• Retardo de crecimiento intrauterino RCIU y salud futura: programming
Las consecuencias adversas del RCIU parecen
prolongarse aún más en el largo plazo. En los últimos años se ha desarrollado un cuerpo de evidencias importante que sustenta la hipótesis de que condiciones nutricionales adversas durante la
vida intrauterina se asocian con factores de riesgo para la enfermedad cardiovascular en la vida adulta.
La coexistencia de obesidad visceral, resistencia a la insulina, alteraciones en el metabolismo de los hidratos de carbono, hipertensión arterial y dislipidemias constituye la constelación de
factores de riesgo de la enfermedad cardiovascular, conocida con el nombre de síndrome X, síndrome de insulino-resistencia o síndrome metabólico.(7,8) La incidencia del mismo está aumentando en niños y adolescentes, especialmente en países en desarrollo y en las minorías de los países
desarrollados.(9)Una posible explicación es la simultaneidad con el incremento de la prevalencia de obesidad, que está alcanzando
proporciones de epidemia en el mundo.(10) Nuestro grupo de trabajo, en un estudio en 182 niños obesos, con edad media de 11 años,
evaluó la presencia de resistencia insulínica en esta población, encontrando que el 65.3% de dicha población presentaba resistencia insulínica medida por HOMA y que la misma se hallaba asociada a
dos o más variables de riesgo cardiovascular en el 46.1% de los niños, constituyéndose en Síndrome Metabólico. En este grupo, un 7% de los pacientes presentó Intolerancia a la Glucosa y un 1.6%
de los mismos Diabetes tipo 2.(11)
La asociación entre bajo peso para edad gestacional y riesgo cardiovascular fue descripta por primera vez en un estudio de cohorte inglés en la década del 90. Desde
entonces, numerosos trabajos confirmaron este hallazgo, investigando los diferentes factores que relacionarían el peso de nacimiento con la homeostasis de la glucosa a lo largo de la vida. En los
últimos años, trabajos en niños con el antecedente de bajo peso para edad gestacional han demostrado manifestaciones del síndrome a edades cada vez más tempranas, hallándose diferencias en los
niveles de glucosa e insulina en ayunas y en el patrón de distribución grasa en niños antes de la pubertad.
Recientes evidencias muestran que la asociación de bajo peso de nacimiento seguido de un patrón hacia la adiposidad constituye el modelo de mayor riesgo de síndrome metabólico y enfermedad
cardiovascular. En este sentido, el estudio de Ericsson, en 1999 encuentra que la mayor frecuencia de muerte por enfermedad cardiovascular en la adultez se da en aquellos con menor
peso de nacimiento y mayor índice de masa corporal a los 11 años de edad.(12)
La hipótesis del “programming” es de particular interés en los países en desarrollo en los que, históricamente, se presentan altas tasas de retardo de crecimiento
intrauterino y postnatal temprano, asociados a las condiciones actuales englobadas en la denominación de “nutrición transicional”, caracterizadas por una alimentación alta en grasas y azúcares
refinados y disminución en los patrones de actividad física, que están condicionando el aumento de la prevalencia de obesidad.(13)
Estudios poblacionales realizados en niños prepúberes con antecedente de bajo peso al nacer, encontraron variables de riesgo de síndrome metabólico asociadas tanto al retardo de crecimiento
intrauterino como al aumento del índice de masa corporal y de la masa grasa corporal total, permitiendo especular a los investigadores que la disminución del crecimiento intrauterino induciría
adaptaciones metabólicas para la supervivencia in útero, permitiendo una mayor disponibilidad de nutrientes, que posteriormente, en situaciones de balance energético positivo, produciría
deposición grasa central, agravando la resistencia a la insulina.(14,15)
El bajo peso de nacimiento ha sido asociado con alteraciones en la tolerancia a los hidratos de carbono y diabetes tipo 2 en la adultez.(16) En este sentido, varios estudios encuentran que el antecedente de RCIU sumado a un mayor crecimiento compensatorio en los primeros años de la vida,
aumentan los índices de insulino-resistencia y la prevalencia de diabetes tipo 2 en esta población.(17)
Estudios recientes en niños, muestran similar asociación entre bajo peso de nacimiento y mayor resistencia a la insulina con concentraciones elevadas en ayunas de proinsulina total, todo lo cual
parece marcar un mayor riesgo para diabetes 2.
Estudios de la dinámica de insulina, muestran que la función de la célula beta es un evento temprano en la cascada metabólica que lleva a diabetes.(18) Bajo circunstancias normales, la conversión de proinsulina a insulina se completa antes de la secreción, llegando al plasma cantidades muy pequeñas de
proinsulina intacta. Individuos con intolerancia a la glucosa tienen aumento en el radio de proinsulina/insulina. Aumentos en los niveles de proinsulina y sus segmentos han sido descriptos en
niños de 8 años en asociación a bajo peso de nacimiento.(19)
Nuestro grupo de trabajo (20), en un reciente estudio, analizó niños con antecedente de RCIU, encontrando que aquellos que desarrollaron
obesidad a los 5 años de edad o presentaron recuperación nutricional del peso al año de vida o centralizaron su distribución grasa, aumentaron significativamente los niveles de proinsulina, en
comparación con los que mantuvieron su proporción de peso para talla o presentaron distribución grasa generalizada. Estos hallazgos, no fueron observados en un grupo control de niños obesos o con
centralización grasa de la misma edad (21). Los resultados de este estudio implicarían que el crecimiento rápido temprano de los individuos
con desnutrición fetal, tendría efectos adversos en la salud a largo plazo de los mismos, mostrando una especial vulnerabilidad para el impacto de la insulino-resistencia sobre la secreción de
células beta.
• Mecanismos postulados
El concepto de “imprinting metabólico” es utilizado para describir los fenómenos biológicos subyacentes que actúan
programando los efectos a largo plazo, muchos de los cuales son entendidos como cambios adaptativos a un ambiente nutricional desfavorable durante períodos críticos.
Recientes estudios sugieren que anormalidades en el eje hipotálamo-hipófisis-adrenal pueden jugar un rol importante, relacionando el retardo de crecimiento intrauterino con la resistencia
insulínica.(21,22,23,24,25) Actualmente se sugiere un mecanismo común subyacente para el origen del programming fetal , el modelo aceptado
propone que tanto la restricción calórica o proteica como el stress materno o la administración exógena de glucocorticoides durante la vida fetal atenúan selectivamente la 11-HSD2 placentaria
(que normalmente inactiva una gran proporción de los corticoides que llegan al feto), aumentando los corticoides circulantes y la sensibilidad de los tejidos periféricos a los mismos, lo que
estimularía la respuesta del eje hipotálamo-hipófiso-suprarenal en la adultez, con programación de sistemas y tejidos claves en el origen de las manifestaciones del síndrome
metabólico.
En síntesis, y a pesar de que los mecanismos específicos que lo determinan aún permanecen desconocidos, numerosos estudios han probado que el ambiente intrauterino adverso puede tener
efectos severos en la transcripción de señales metabólicas, produciendo un “programming” de respuestas endocrinas que agravadas por un crecimiento acelerado posterior, pueden producir cambios
metabólicos permanentes, originando resistencia a la insulina, factor común a todos los componentes del síndrome metabólico.
En nuestro país, como en todos los países en desarrollo, es aún importante la incidencia del bajo peso al nacer y el retardo de crecimiento intrauterino. Es importante recalcar que, las mismas
condiciones socioeconómicas que juegan un rol en la etiología de la desnutrición fetal, relacionadas con el estado nutricional, de salud general, social y psicológico de las madres, son las que
favorecen el desarrollo posterior de obesidad en la infancia, a través del ambiente obesógeno de la pobreza, (acceso a dietas hipercalóricas de baja calidad nutricional o la falta de acceso a
actividades deportivas y recreativas en ámbitos seguros, que permitan mantener a estos niños, un gasto metabólico adecuado).
En este contexto, este grupo de niños suma a los riesgos de morbimortalidad directa, por su condición, el riesgo futuro al que es expuesto asociado con la enfermedad cardiovascular del adulto. Un
grupo importante de estos niños no sobrevivirá a la etapa perinatal, los que lo logren, tendrán altas probabilidades de enfermar en los primeros años de vida, y la evidencia nos muestra que
aquellos que logren traspasar esta primer etapa, presentarán un riesgo elevado de padecer la constelación de enfermedades crónicas no transmisibles del adulto, conocidas como síndrome metabólico,
probablemente a edades más tempranas que en las que se presenta en la población general. La identificación de estos subgrupos de alto riesgo, permitirá establecer las estrategias de salud
necesarias para la prevención de la morbimortalidad asociada.
7. De Fronzo R, Ferranini E. Insulin resistance: a multifaceted syndrome responsable for NIDDM, obesity, hypertension, dyslipidemia and atheroesclerotic cardiovascular diseases. Diabetes care
1991; 14:173-94
8. Reaven G. Rol of insulin resistance in human disease. Diabetes 1988;
37:1597-1607
9. Pinhas-Hamiel O, Dolan L, Daniels S, Satnford D, Khoury P, Zeitler P. Increased incidence of
non-insulin dependent diabetes mellitus among adolescents. J Pediatr 1996; 128:608-615
10. Barker D, Hales C, Fall C, Osmond C, Phipps K, Clark P. Type 2 diabetes, hypertension and
hyperlipidaemia (syndrome X): relation to reduced fetal growth. Diabetologia 1993; 36:62-67
11. Mazza CS, Ozuna B, Krochik AG, Araujo MB. Prevalence of type 2 Diabetes Mellitas and Impaired
Glucose Tolerance in Obese Argentinean Children and Adolescents. J Pediatr Endocr Metab 2005; 18 (4):
12. Eriksson JG, Forsen T, Tuomilehto J, Winter PD, Osmond C, Barrer DJP. Catch up growth in
childhood and death from coronary heart disease: longitudinal study. BMJ 1999; 318: 427-31
13. Bavdekar A, Yajnik C, Fall C, Bapat S, Pandit A Deshpande V, Bhave S, Kellingray S, Joglekar C.
Insulin resistance syndrome in 8 year-old Indian children. Small at birth, big at 8 years, or both?. Diabetes 1999; 48:2422- 29
14. Ong K, Ahmed M, Emmet P, Preece M, Dunger D.
Assiciation between posnatal catch-up growth and obesity in childhood: prospective cohort study. BMJ 2000; 320:967-971
15. Jaquet D, Gaborian A, Czernichow P, Levy-Marchal C.
Insulin resistance early in adulthood in subjects born with intrauterine growth retardation. J Clin Endocrinol Metab 2000; 85:1401-06
16. De Fronzo R. Pathogenesis of type 2 (non insulin dependent) diabetes mellitus: a balanced overview. Diabetologia 1992; 35:389-97
17. Bhargava SK, Sachdev HS, Fall CHD, Osmond C, Lakshmy R, Barrer DLP, Biswas SKO, Ramji S, Prebinakaran D, Reddy S. Relation of Serial Changes in Childhood Body-Mass Index to Impaired Glucose
Tolerance in Young Adulthood. N Eng J Med 2004; 350:865-75
18. Linde SA, Roder M, Hartling S, Binder C, Welinder B. Separation and quantification of serum proinsulin and proinsulin intermediate in human. J of Chromatography 1991; 548:371-80
19. Nagi D, Knowler W, Mohamed Ali V, Bennett P, Judkin J. Intact proinsulin, des 31,32 proinsulin and especific insulin concentrations among nondiabetic and diabetic subjects in populations at
varying risk of type 2 diabetes. Diabetes Care; 21:127-33
20. Krochik AG, Mazza CS. Retardo de crecimiento intrauterino y manifestaciones tempranas de factores de riesgo de enfermedad cardiovascular del adulto (Síndrome metabólico). Beca “Ramon
Carrillo-Arturo Oñativia 2002/2003” Comisión Nacional de Programas de Investigación Sanitaria Conapris. Ministerio de Salud y Ambiente de la Nación
21. Krochik AG, Chaler EA, Maceiras M, Aspres N, Mazza CS. Presence of early risk markers of metabolic syndrome in prepubertal children with a history of intrauterine growth restriction. Arch
Argent Pediatr. 2010 Feb;108(1):10-6
22. Phillips D, Barker D, Fall C, Seckl J, Whorwood C, Wood P, Walker B. Elevated plasma cortisol concentrations: a link between low birth weith and the insulin resistance syndrome?. J Clin
Endocrinol Metab 1998; 83:757-60
23. Sekl JR. Prenatal glucocorticoids and long term programming. Eur J Endocr 2004; 151:U49-U62
24. Ogueh O, Johnson MR. The metabolic effect of antenatal corticosteroid therapy. Human Reprod Update 2000; 6: 169-76
25. Cleasby ME, Nelly PAT, Walter BR, Shekel JR. Programming of rat muscle and fat metabolism by utero overexposure to glucocorticoids. Endocrinology 2003; 144: 999-1007.
Autor: Dra. Gabriela Krochik - M.N. 80.212
Médica Asistente Servicio de
Nutrición
Hospital JP Garrahan
Dra. Cármen S. Mazza - M.N. 31384
Jefa de Servicio de Nutrición
Hospital JP Garrahan
Obesidad Infantil
1º parte
La prevalencia de obesidad esta aumentando en
forma dramática de manera universal abarcando tanto a los países desarrollados, como a los países en desarrollo. En Argentina, la obesidad constituye ya una epidemia. Datos
provistos por un estudio realizado a través de la Sociedad Argentina de Pediatría en una muestra representativa de niños y adolescentes atendidos en consultorios pediátricos de todo el país,
arrojó cifras similares a la de países con niveles considerados de epidemia. La prevalencia en éste grupo etario fue de 20.8% para sobrepeso y 5.4% para obesidad.
La encuesta nacional de salud (ENNIS) muestra en niños de 2 a 5 años una prevalencia del 6,6% de niños obesos tomando como definición el valor de corte superior a 120 % peso para talla de las
tablas de la Sociedad Argentina de pediatría y en mujeres de 19 a 49 años y 44 % de sobrepeso y obesidad.
La obesidad en la infancia constituye una de las afecciones que condiciona importante comorbilidad. Algunas alteraciones como la insulinorresistencia y diabetes 2, hipertensión, síndrome
metabólico , síndrome de apnea obstructiva del sueño hígado graso , son de presentación en la niñez y adolescencia. Es factor de riesgo independiente para enfermedad cardiovascular, y algunos
tipos de cáncer.
La adiposidad y particularmente la de distribución de tipo visceral o intra abdominal, es la causa mas frecuente de insulinorresistencia en adultos y también en niños.
En Latinoamérica a pesar de que la desnutrición continúa siendo un problema prevalente, hay acuerdo que tanto el sobrepeso como la obesidad son alteraciones nutricionales que también se presentan
en la pobreza.
Por otra parte la obesidad infantil esta fuertemente correlacionada con la obesidad del adulto. Los valores de IMC son predictivos del nivel de obesidad en la vida adulta, habiéndose estimado que
alrededor del 40% de los chicos con sobrepeso serán obesos en la vida adulta (valor predictivo del peso) mientras que el 15 al 20 % de los adultos obesos han sido obesos en su infancia
(sensibilidad).
En este contexto, la detección y prevención temprana es rol del pediatra en el nivel de atención primaria y debe estar enfocada como prioridad particularmente en la población de
riesgo.
Definición y diagnóstico:
Como se define la obesidad? De una manera muy simple: como el exceso de grasa corporal. Los métodos para cuantificar grasa corporal son complejos y poco utilizados en la clínica.
Se acepta que los indicadores antropométricos, por lo económicos, y simples son lo de mayor utilidad. Dentro de estos el indice de masa corporal (IMC) que se obtiene dividiendo el peso (en
kilogramos) por la estatura (en cm) elevada al cuadrado es el que mejor correlaciona con grasa corporal.
Se utilizan como tablas de referencias las de la Organización mundial de la salud y con estas tablas se define:
• Normopeso: los niños con IMC entre percentilos 10 y 85.
• Sobrepeso cuando el: los niños con IMC = al percentilo 85 y < a 95 de las tablas de referencias.
• Obesidad: los niños IMC = al percentilo 95.
En niños menores de 2 años se desaconseja el uso del término obeso y solo se usa sobrepeso con los dos indicadores siguientes:
• Peso para talla: Se considera sobrepeso cuando = 95. o Score z mas e DS de peso para talla
• IMC .Score z superior a 2 DS
Perímetro de cintura: es una medida
de la cantidad de grasa depositada en el compartimento viscera; que aumenta riesgo cardiometabólico.
La medición puede realizarse en cuatro sitios: cresta ilíaca , punto medio, cintura mínima o a nivel del ombligo. Se considera obesidad visceral o central cuando el perímetro de cintura es
superior al percentilo 90 de acuerdo a tablas de referencias.
Etiología : Factores de riego
La obesidad es una condición de etiología multifactoral de graves consecuencias médicas psicológicas y psicosociales.
Básicamente es el resultado de un disbalance entre el ingreso de energía y el gasto, lo que resulta en un aumento del tejido adiposo como órgano de almacenamiento de energía en forma de
triglicéridos. Dependiendo de donde se distribuya este tejido adiposo va a determinar el mayor o menor grado de complicaciones.
El concepto de multifactoriedad implica que los mecanismos que alteran el balance calórico a través de mayor ingesta o menor gasto, son variados , y resultan de la interacción de factores
ambientales y factores genéticos.
En la figura 1 se esquematiza el enfoque integrador de los mecanismo que generan obesidad. El ambiente obesogénico actual, descripto como transición nutricional, se caracteriza
por un cambio en los patrones nutricionales que incluye aumento de alimentos ricos en hidratos de carbono refinados, y grasas saturadas, procesados, pobres en fibras, frutas, verduras, y calcio,
aumento de las porciones, de bebidas carbonatadas y comidas rápidas, mientras que la modernidad incluyendo la tecnología, se asocia a disminución del gasto por disminución de la actividad física:
horas de televisión y computadora, falta de espacio para juego, pocas horas de actividad en la currícula escolar son algunos de los factores involucrados.
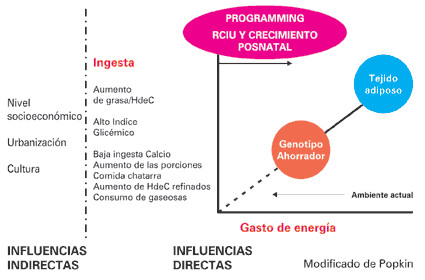
Sin embargo el desarrollo de la obesidad no puede
atribuirse únicamente a los factores ambientales, tiene un papel relevante la carga genética en la susceptibilidad al desarrollo de obesidad. Las formas más comunes de obesidad presentan una
forma de herencia no mendeliana, habiendose postulado un importante número de genes candidatos. Los mecanismos po-ligénicos en la etiopatogenia de la obesidad involucran modificaciones sobre el
comportamiento alimentario o la regulación endócrina del apetito, adipogénesis y eficiencia energética. El tipo de herencia de las enfermedades poligénicas no está completamente establecido, pero
se postula que varios loci menores serían los determinantes de un porcentaje pequeño de casos produciendo una importante dispersión entre las diferentes alteraciones.
Pero el genoma humano no ha cambiado y la frecuencia de obesidad se ha duplicado en los últimos 30 años por lo que el esfuerzo por frenar la epidemia debe estar focalizado en los cambios que se
desarrollaron en el ambiente.
A continuación se describen los factores que estan asociados de manera independiente a obesidad temprana y que proveen ventanas de oportunidad para actuar en la prevención.
Factores independientemente asociados a obesidad
a. Factores intrauterinos y perinatales
• El peso de nacimiento describe una curva en U ya que tanto el bajo (2.500 gr) como el alto (4000 gr) peso de nacimiento se asocian con
mayor riesgo de obesidad. La mayor relevancia de los pacientes con antecedentes de Retardo de Crecimiento Intrauterino (RCIU) es que además de conferirle mayor riesgo de obesidad, también le
otorga mayor propensión a desarrollar comorbilidades.
• Tabaquismo durante el embarazo. Se postula que el tabaquismo materno podría afectar la regulación del apetito en el cerebro en
desarrollo. Por otra parte la disminución de la ingesta materna por la supresión del apetito, la vasoconstricción inducida por la nicotina y un aumento en la exposición a monóxido de carbono
afectaría el crecimiento y desarrollo fetales.
• Obesidad materna durante el embarazo. Especialmente durante el primer trimestre. El mayor riesgo de obesidad estaría conferido en parte
por la herencia genética de mayor susceptibilidad a la obesidad, el efecto de la obesidad en el medio intrauterino y el rol materno en la alimentación y la actividad física postnatal. Los
períodos preconcepcional, durante el embarazo y en los primeros años de vida, proveen de importantes oportunidades para prevenir la obesidad impidiendo el ciclo intergeneracional que promueve la
obesidad.
• Diabetes materna. La alteración del metabolismo glucosa-insulina materno podría provocar un cambio en la producción y sensibilidad
insulínica de su descendencia incrementando el riesgo de obesidad y posteriormente de diabetes tipo 2.
b. Alimentación del lactante
• Lactancia materna. Surge de la evidencia de distintos meta-análisis la asociación entre lactancia y reducción del riesgo de obesidad.
Algunos trabajos sostienen que existe una relación dosis dependiente entre la mayor duración de la lactancia y la protección conferida, concluyendo que por cada mes de lactancia disminuiría en un
4% el riesgo de obesidad alcanzando una “meseta” a los 9 meses de la misma. Este efecto podría en parte ser secundario a la menor ganancia de peso en el período crítico neonatal lo que
influenciaría el desarrollo de neurocircuitos en el hipotálamo que regulan el apetito y el control de peso.
c. Característica de la familia
• Obesidad parental. Podría aumentar el riesgo de obesidad a través de mecanismos genéticos o por compartir características ambientales
familiares.
La obesidad paterna aumenta 2.5 veces el riesgo de obesidad en sus hijos, la obesidad materna 4.2 veces, y la presencia de ambos padres obesos les confiere un incremento de 10.4 veces de
desarrollar obesidad.
• Bajo nivel socioeconómico. Crecer en un ambiente de medianos a bajos ingresos aumenta 1.6 y 2.5 veces respectivamente el riesgo de
obesidad en la niñez. El nivel socioeconómico influye en el tipo de comida consumida en el hogar.
• Preferencias alimentarias de los padres. Está demostrado que el consumo de frutas y verduras en los padres incrementa su consumo en los
hijos.
d. Estilo de vida en la infancia temprana
• Número de horas frente a la T.V./pantalla. El riesgo de obesidad aumenta linealmente con el número de horas frente a la TV. Sería
secundario a la reducción del gasto energético, está asociado a la ingesta y altera la regulación del balance energético por desacoplamiento ingesta alimentaria del gasto energético.
e. Características concernientes al crecimiento del
niño
• Mayor tamaño a los 8 y 18 meses de edad. El peso por encima del Pc 75 a las edades citadas confiere mayor riesgo de obesidad.
• Rebote adipocitario temprano. En particular cuando se produce antes de los 43 meses de edad. El rebote adipocitario corresponde al
segundo incremento en la curva de índice de Masa Corporal que ocurre entre los 5 y 7 años de edad. Un rebote adipocitario temprano (3.2 años) se asocia con un incremento en el riesgo de obesidad
y está inversamente relacionado a la edad ósea y refleja un crecimiento acelerado. El patrón asociado es un IMC bajo seguido de un incremento del mismo luego del rebote adipocitario temprano,
relacionado al aumento en la ganancia de masa grasa cuando previamente existía un déficit que pudo haber generado un metabolismo adaptativo (programming) que se convierte en perjudicial en etapas
posteriores. La edad del rebote adipocitario ha sido identificado como un factor predictor de masa grasa en la adultez y con el desarrollo de diabetes tipo 2 y enfermedad cardiovascular. Evaluar
la presencia del rebote adipocitario temprano es un mejor indicador del momento del comienzo de la obesidad en vez del IMC alto, el cual sólo va a aparecer después de un progresivo incremento a
través de los años.
• Catch-up desde el nacimiento a los dos años de vida. El catch-up es una propiedad del crecimiento humano mediante el cual (whereby) el
niño retorna a su trayecto genético luego de un período de crecimiento arrest o delay por distintos motivos (por ejemplo una enfermedad) y puede ocurrir en cualquier momento de la vida, pero en
especial un catch-up pronunciado suele verse entre los 0 y 2 años luego de una restricción severa del crecimiento intauterino. La definición del catch-up es el cruce de por lo menos un percentilo
hacia arriba en la tabla de referencia de peso o talla que corresponde a 0.67 Desvíos Standard. La variación en la tasa de crecimiento habitualmente compensa la restricción o el aumento excesivo
de peso intrauterino y a partir de los dos años de edad normalmente sigue la trayectoria genética. La presencia de catch-up estaría relacionada al menor peso de nacimiento, a bajo peso materno de
nacimiento y a primigestas.
• Alta tasa de ganancia de peso en los primeros 12 meses de vida.
Continúa en nuestra próxima edición con: factores
de riesgo del sobrepeso, obesidad y tratamiento.
Autor: Dra. Cármen S. Mazza - M.N. 31384
Jefa de Servicio de Nutrición Hospital JP Garrahan
Cereales de consumo
habitual por nuestros niños
Cereales para el desayuno
Nuestro objetivo es que los padres puedan conocer sus características nutricionales, sin dejarse influenciar por la publicidad, regalos o slogans utilizados para promover su venta, dado que se
promocionan como saludables.
Los cereales se obtienen a partir de diversos granos, principalmente de trigo, maíz, arroz y a veces de la mezcla de varias harinas, azúcar, miel y chocolate o cacao, aditivos como endulzantes
(fructosa, jarabe de glucosa-fructosa), aceite vegetal, sal, extracto de malta de cebada y colorantes (caramelo, beta-caroteno). Generalmente están fortificados con vitaminas del complejo B,
vitamina D y minerales (calcio y hierro). Pueden contener otros ingredientes: leche en polvo, huevo , frutos secos.
El azúcar y la sal son utilizados para realzar el sabor y conservar la consistencia crocante.
Los productos disponibles en nuestro mercado tienen un contenido de azúcares promedio de 9 gr por porción de 30 gr (de 3 a 12 según el producto), lo que equivale a 2 cucharadas tamaño té de
azúcar. Es importante tenerlo en cuenta, pues muchos niños acostumbran agregar azúcar a la leche con la que acompañan estos cereales.
A pesar que estos productos no se perciben como salados, contienen elevado contenido de sal (promedio 110 mg).
Al elegir un determinado producto dentro de este grupo, se recomienda leer la información nutricional por cada porción de 30 gr (aproximadamente 3/4 de taza), y elegir aquellos con menor
contenido de sodio, azúcar, y grasas.
Se recomienda respetar el tamaño de porción indicado, y no agregar azúcar ni polvos saborizados a la leche con que se acompañan, para evitar un excesivo aporte de calorías, azúcares y
sal.
Barras de cereales
Las barras de cereales han ingresado al mercado en los últimos años, y su producción ha aumentado debido a la gran aceptación que han tenido tanto en el público adulto como infantil. Los
ingredientes más abundantes de las barritas son los cereales: copos de avena, trigo, maíz, arroz o salvado, entre otros. Su composición nutricional varía de acuerdo a los ingredientes agregados
(frutas secas, chocolate, fruta, etc).
El valor energético oscila entre 60 a 150 calorías por unidad, siendo unas de las más calóricas las que se anuncian “con yoghurt”. Algunas barras light reducen las calorías a expensas de su menor
gramaje. Su densidad calórica va de 3.5 a 4.5 calorías/gramo. Los hidratos de carbono (en gran medida los azúcares) son los nutrientes más relevantes (jarabes de glucosa, glucosa, miel o azúcar).
Las versiones reducidas en calorías contienen jarabe de maltitol y polidextrosa. El contenido de grasas es variable de acuerdo al producto (en un rango de entre 4 y 26%), y depende de sus
ingredientes: chocolate, frutos secos y aceites vegetales.
El contenido de fibra en la mayoría de las barritas es bajo, pero existen productos con 6 gr de fibra por porción.
Las barras de cereal pueden incorporarse en la alimentación de los niños, pero buscando entre ellas las de mejor calidad nutricional (menor densidad calórica, mayor contenido de fibra y
menor contenido de grasas y sodio).
Pueden colaborar a brindar colaciones prácticas de llevar cuando se está fuera de casa. Recomendamos consumir una por vez y que no sean un reemplazo cotidiano de otras opciones variadas para
desayunos y meriendas.
Autores: Grupo de Trabajo Nutrición y
Pediatría de la
Sociedad Argentina de Nutrición
Lic. Alejandra Franchello - M.N. 1.219
Dra. Silvia Jacobez - M.N. 82.859
Dra. Florencia Flax Marcó - M.N. 2.173
Dra. Adriana Roussos - M.N. 75.749
Dra. Teresa Larocca - M.N. 53.513
Dra. María Rosario De Leo - M.N. 56.977
Dra. Susana Barbeito - M.N. 54.688
Lic. Andrea Rochaix - M.N. 1.507
Lic. Romina Alculumbre - M.N. 2.818


